
Терминология в гетерогенном катализе
под ред. Р.П.Бурвелла (продолжение)
Русский перевод
Ориганальная версия
О шестой рамочной программе Евросоюза
За рубежом
Приглашения на конференции
(Продолжение, начало см. "Каталитический Бюллетень" N1(33), 2005, с. 24-61)
1.3 Состав, структура и текстура катализаторов
1.3.1 Общие термины
Катализаторы могут быть однофазными или двухфазными. В первом случае они могут содержать одно вещество (например, оксид алюминия или платиновую чернь) или быть однофазным раствором одного или более веществ. В этом случае компоненты раствора должны представляться соединенными дефисом (например, окись кремния-окись алюминия).
Носитель. В многофазных катализаторах каталитически активный материал часто присутствует в малом количестве как компонент, диспергированный на носителе (support или, иногда, carrier). Носитель может быть каталитически инертным, но вносить вклад в суммарную каталитическую активность. Предельный случай - это некоторые бифункциональные катализаторы (§1.2.8). Такой катализатор следует называть, начиная с активного компонента, на втором месте следует носитель, и эти два слова или фразы разделяются косой чертой, например, платина/окись кремния или платина/алюмосиликат. Косая черта иногда заменяется словом "на", например, платина на окиси алюминия.
Промотор. В некоторых случаях добавление относительно небольшого количества одного или более веществ, промотора или промоторов, к катализатору повышает активность, селективность или полезное время работы катализатора. В общем случае промотор может либо ускорить целевую реакцию, или подавить нежелательную. Не существует формальной номенклатурной системы для обозначения промотированных катализаторов. Можно, однако, использовать фразу "железо, промотированное окисью алюминия и окисью калия".
Промотор, действие которого направлено на уменьшение тенденции к спеканию и уменьшению поверхности, может быть назван текстурным промотором (см. §1.7.3).
Легирование. В случае полупроводящих катализаторов, небольшое количество примесного материала, растворенного в исходном катализаторе, может изменять скорость определенной реакции. Это явление иногда называется легированием по аналогии с действием подобного материала на полупроводимость.
.1.3.2 Пористость и текстура
Многие, но не все катализаторы - пористые материалы, в которых большая часть площади поверхности является внутренней. Иногда удобно говорить о структуре и текстуре таких материалах. Структура определяется как распределение в пространстве атомов или ионов в материальной части катализатора, и особенно как распределение по поверхности. Текстура определяется как детальная геометрия пустого пространства в частицах катализатора. Пористость - это понятие, связанное с текстурой и относящееся к пористому пространству в материале. Однако в случае цеолитов пористость, в основном, определяется кристаллической структурой.
Точное описание текстуры пористого катализатора потребовало бы детального определения очень большого числа параметров. Часто используются следующие усредненные свойства.
В случае пористых твердых веществ поверхность, связанная с порами, может быть названа внутренней поверхностью. Так как доступность пор может зависеть от размера молекул жидкости или газа, протяженность доступной внутренней поверхности может зависеть от размера молекул, составляющих жидкость или газ, и может различаться для компонентов жидкой или газообразной смеси (эффект молекулярного сита).
Когда пористое тело состоит из дискретных частиц, удобно описывать наружную границу частиц как внешнюю поверхность.
Целесообразно классифицировать поры в соответствии с их размерами:
Не рекомендуются термины промежуточные или переходные поры, которые часто использовались в прошлом.
В случае микропор их суммарный доступный объем может рассматриваться как адсорбционное пространство.
Вышеперечисленные ограничения в некоторой степени произвольны. В определенных обстоятельствах может оказаться удобным выбрать какие-либо другие величины.
Распределение пор по размерам - это распределение объема пор по размерам пор; другими словами оно может быть определено как соответствующее распределение площади по размерам пор. Это важный фактор кинетического поведения пористого катализатора и, таким образом, существенное свойство для их охарактеризования (см. §1.6).
Расчет такого распределения включает произвольные допущения, и распределение пор по размерам всегда должно сопровождаться указанием на то, какой метод использован для их определения. Обычно используются либо один, либо оба следующих метода: (i) изотермы адсорбции-десорбции азота или других адсорбтивов в сочетании с соответствующей моделью конвертирования изотермы в распределение пор по размерам; (ii) данные, полученные с помощью ртутной порометрии. Такие изотермы дают распределение для размеров мезопор. Ртутная порометрия дает распределение для макропор и более крупных мезопор. В обоих случаях то, что измерено, является, строго говоря, не точным объемом пор данного размера, а объемом пор, доступных через поры данного размера. Соотношение этих двух функций зависит от геометрической природы системы пор.
Удельный объем пор - это суммарный объем внутренних пустот на единицу массы адсорбента. Часть объема пор может быть полностью закрыта и поэтому недоступна для молекул, участвующих в каталитической реакции.
Суммарный доступный объем пор может быть измерен количеством адсорбата при давлении насыщения адсорбтива, рассчитанного как объем жидкости, при условии, что адсорбция на внешней поверхности пренебрежимо мала или может быть оценена. Доступный объем пор может различаться для молекул разного размера. Методом, на который не влияет внешняя поверхность, является определение мертвого пространства с помощью несорбируемого газа (обычно гелия) в сочетании с определением общего объема адсорбента с использованием несмачивающей жидкости или геометрических измерений.
Первичные частицы. Некоторые материалы, широко используемые как катализаторы или носители, состоят из сфероидов диаметром около 10 нм (100 Å), прочно связанных в гранулы или таблетки. По текстуре они подобны сцементированному рыхлому слою гравия. Эти частицы диаметром 10 нм (100 Å) можно назвать первичными частицами.
Степень использования (percentage exposed) металлических катализаторов. Доступность атомов металла в нанесенных или ненанесенных металлических катализаторах зависит от доли атомов от общего числа атомов металла, которые являются поверхностными. Рекомендуется это количество обозначать термином степень использования, а не часто используемым термином дисперсность.
Предварительная обработка и активация. После приготовления или загрузки в каталитический реактор катализатор часто подвергается различным обработкам перед началом каталитического процесса. Термин предварительная обработка может, в общем, применяться для набора таких обработок. В некоторых случаях используется слово активация. Оно означает, что материал превращается в катализатор или намного более эффективный материал в результате предварительной обработки. Одной из форм такой обработки является дегазация, при которой катализатор нагревается в вакууме для удаления адсорбированного или растворенного газа. Прокалка - это термин, обозначающий нагревание в воздухе или кислороде, относящийся скорее всего к стадии приготовления катализатора.
1.4 Каталитические реакторы
Сосуд, в котором проводится каталитическая реакция, называется реактором. Множество разнообразных устройств может применяться для введения реагентов и вывода продуктов.
В реакторе периодического действия реагенты и катализатор помещаются в реактор, который затем перекрывается для транспорта вещества, и реакцию проводят в течение заданного времени, после чего выводится смесь непрореагировавшего вещества и продуктов.
В проточном реакторе реагенты пропускаются через реактор, пока работает катализатор. Возможно множество вариантов.
Катализатор может быть организован в видеслоя, а реагенты пропускаются над ним. Проточный реактор со слоем катализатора обычно называется реактором с закрепленным слоем, а термин реактор идеального вытесненияиспользуется также и для указания, что не обеспечивается возвратное смешивание реакционной смеси по мере того, как она проходит через реактор. Проточный реактор работает, в основном, в дифференциальном режиме с участием небольших порций, так что состав смеси практически постоянен по длине каталитического слоя, или интегральном с участием бόльших порций, так что состав материала на выходе из слоя катализатора отличается от состава на входе.
В импульсном реакторе газ-носитель, в качестве которого может использоваться инертный газ или один из реагентов, пропускается над катализатором, а небольшие порции другого реагента или реагентов вводятся в газ-носитель через определенные промежутки времени. Импульсный реактор полезен в исследовательских работах, но кинетические результаты применимы скорее к промежуточным, чем к стационарным условиям катализатора.
Можно использовать другие режимы работы во избежание осложнений, связанных с изменением концентраций по длине каталитического слоя, связанных с интегральными проточными реакторами, каждый из режимов обозначается специальным термином. В проточном реакторе прямым перемешиванием эффективное смешивание часто обеспечивается использованием быстро вращающихся корзин, в которые загружается катализатор. Если такое перемешивание результативно, состав смеси в реакторе будет близок к составу газов на выходе.
Тот же результат может обеспечиваться рециркуляцией газа по контуру, содержащему закрепленный слой катализатора, при условии, что скорость рециркуляции намного больше скорости потока в контур и из него. В таких условиях может быть получена существенная конверсия в продукты, даже если условия в слое похожи скорее на условия дифференциального, чем интегрального реактора. Другой рабочий режим связан с использованием псевдоожиженного слоя, в котором тонкие частицы катализатора ведут себя подобно жидкости под воздействием достаточно интенсивного потока газов. Температура сохраняется постоянной во всем псевдоожиженном слое, несмотря на то, что газ и жидкость обычно не полностью смешиваются. В частности, он применяется в тех случаях, когда катализатор должен регенерироваться, например, окислением, после непродолжительного использования. Постоянный перенос катализатора между двумя сосудами (один из которых используется как реактор, а другой - для регенерации катализатора) возможно осуществить с использованием ожиженной системы. Проточные и рециркуляционные реакторы с перемешиванием характеризуются, в идеале, очень маленькими градиентами концентрации и температуры в каталитической зоне. В обоих случаях можно использовать термин безградиентный реактор.
Все реакторы, периодические или проточные, могут работать в трех основных температурных режимах. Это изотермический, адиабатическийи температурно-программируемый режимы. В последнем случае можно программировать изменения температуры во времени в реакторе периодического действия или задавать изменения температуры по длине слоя в реакторе с закрепленным слоем.
При изотермическом режиме реактор периодического действия характеризуется концентрацией адсорбатов и другими параметрами состояния поверхности, постоянными в пространстве (т.е. однородными в массе катализатора), но изменяющимися во времени. В проточном интегральном реакторе с катализатором со стационарной активностью условия на поверхности постоянны во времени, но изменяются по слою. В безградиентном реакторе в стационарном состоянии поверхностные условия постоянны в пространстве и, если катализатор находится в стационарном состоянии, во времени. В импульсном реакторе катализатор часто находится не в стационарном состоянии, концентрации изменяются по мере того, как импульс проходит через слой, а реагенты и продукты могут разделяться хроматографическими методами.
В общем случае, если гетерогенную реакцию надо проводить в изотермических условиях, конструкция реактора должна обеспечивать поток тепла к частицам катализатора или от них для того, чтобы удерживать небольшой температурный градиент. Иначе температура в слое катализатора не будет однородной. В этом смысле имеют преимущество дифференциальные реакторы и разные типы безградиентных реакторов.
Вышеописанные типы реакторов могут, в принципе, быть распространены на реакции в жидкой фазе, хотя импульсные реакторы в этом случае используются редко.
Реакции, в которых один реагент находится в газовой, а другие - в жидкой фазах с катализатором, распределенным в жидкой фазе, составляют особый, но не необычный случай, например, гидрирование жидких алкенов на платиновом катализаторе. Для лабораторных исследований таких реакций чаще всего используют реактор периодического действия. Массоперенос из газовой в жидкую фазу может снизить скорость такой каталитической реакции, если не обеспечить хороший контакт между газом и жидкостью (см. §1.6).
1.5 Кинетика гетерогенных каталитических реакций
1.5.1 Общие термины
Рассмотрим химическую реакцию
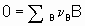
где n B - стехиометрический коэффициент (плюс для продуктов, минус для реагентов) любого продукта или реагента B. Степень реакции x определяется (см. §11.1 Руководства) как
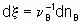
где nB - количество вещества B.
Если однозначно определить скорость реакции, то это - скорость прироста степени реакции
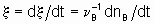
тогда как количество dnB/dt можно назвать скоростью образования(или расхода) B.
Чтобы облегчить сравнение результатов разных исследователей, скорости гетерогенных каталитических реакций должны быть должным образом выражены, а условия, при которых они были измерены, должны быть подробно описаны. Если скорость некаталитизируемой реакции пренебрежимо мала, то скорость катализируемой реакции можно определить как
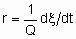
Если Q, количество катализатора - это масса,
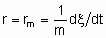
то rm - удельная скорость реакции, которую можно назвать удельной активностью катализатора в определенных условиях. Если Q - это объем,
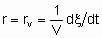
За объем принимается объем гранул без объема пространства между гранулами. Если Q - это поверхность, то
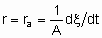
где ra - поверхостная скорость реакции. Если используется общая площадь поверхности катализатора, то предпочтительно использовать поверхность, определенную методом БЭТ с помощью адсорбции азота. Однако могут применяться и другие способы определения поверхности, например, доступная поверхность металла в нанесенных металлических катализаторах. Доступная поверхность металла часто оценивается с помощью селективной хемосорбции подходящего сорбтива, например, водорода или монокиси углерода.
Частота оборотов N,(обычно ее называют числом оборотов) определяемая, как и в катализе ферментами, как число молекул, прореагировавших на активном центре в единицу времени, может быть полезным понятием, если использовать его с осторожностью. С точки зрения проблемы измерения числа активных центров, рассмотренной в §1.2.4, важно точно определить, как именно выражается Q через активные центры. Реальной мерой таких центров может быть число поверхностных атомов металла в нанесенном катализаторе, но в других случаях единственно возможной может быть оценка, базирующаяся на удельной величине поверхности по БЭТ методу. Конечно, числа оборотов (подобно скоростям) должны быть отнесены к конкретным условиям, таким как температура, начальная концентрация или начальное парциальное давление, или степень реакции.
При сравнении различных катализаторов для данной реакции или различных реакций на данном катализаторе может оказаться неудобно или невозможно сравнивать скорости при конкретной температуре, так как скорости должны измеряться при температурах, при которых они имеют обычные величины. Поэтому может оказаться целесообразным сравнивать температуры, при которых скорости имеют конкретные значения.
В реакторах с пространственно однородными концентрациями реагентов и продуктов скорости одинаковы по всей поверхности катализатора в любой момент времени. Однако в проточных интегральных реакторах скорость на каждом участке каталитического слоя меняется по длине.
Селективность
Термин "селективность", S используется для описания относительных скоростей двух или более конкурирующих реакций на одном катализаторе. Такая конкуренция подразумевает как разные реагенты, подвергающиеся одновременным превращениям, так и один реагент, участвующий в двух или более реакциях. В последнем случае S может быть определена двумя способами. Первый из них определяет избирательную селективность SF по каждому продукту по уравнению
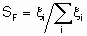
а второй определяет относительную селективность SR по каждой паре продуктов:
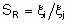
При селективности по форме, которая может наблюдаться в катализаторах с очень маленькими порами, селективность в большой степени определяется объемом или размером одного или более реагентов. На цеолитах, например, реакция алканов с линейными углеродными цепочками может идти с намного большей скоростью, чем реакция с разветвленными цепочками.
1.5.3 Уравнения скорости
Сначала рассмотрим газообразные системы, в которых все концентрации пространственно однородны и в которых реакция необратима.
Скорость x , кроме того, что она пропорциональна количеству катализатора Q, также является в общем случае функцией температуры T и концентраций ci или парциальных давлений pi реагентов, продуктов или других веществ, если они присутствуют:
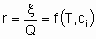
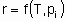
Такая форма уравнения обычно называется уравнением скорости или законом скорости. В гетерогенном катализе функция f часто записывается в форме
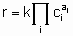
где k - константа скорости, являющаяся функцией температуры, но не концентрации, а ai (целое или дробное; положительное, отрицательное число или ноль) - это порядок реакции по компоненту i. Такая форма закона скорости называется степенным законом скорости. Однако, часто для скорости используется дифференциальная форма записи. Например, для реакции А + В → продукты уравнением скорости может быть
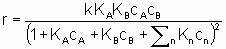
Интерпретация этого уравнения возможна с точки зрения изотерм адсорбции Лэнгмюра. Предполагается (см. §1.5.4), что оба реагента должны адсорбироваться, чтобы вступить в реакцию, и что KA и KB - это соответствующие константы равновесия адсорбции Лэнгмюра. Знаменатель учитывает конкуренцию за места между реагентами и другими веществами (растворители, яды и продукты), присутствующими в системе в концентрациях cn, с соответствующими константами равновесия адсорбции Kn. Закон скорости в таком виде можно назвать законом скорости Лэнгмюра, хотя он был введен в использование Хиншельвудом, Швабом, Хоугеном, Ватсоном и др. Такие законы скорости часто используются в применении к системам, в которых адсорбция не подчиняется изотерме адсорбции Лэнгмюра. В таких условиях законы скорости все же могут дать удобное средство сопоставления экспериментальных результатов, величины выведенных констант следует использовать с осторожностью.
Для отдельного элементарного процесса
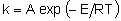
где А - это частотный фактор, а Е - энергия активации. Несмотря на то, что гетерогенные каталитические реакции редко (или даже никогда) состоят из одного элементарного процесса, такое же соотношение часто применяется для определения общей константы скорости. В таком случае, однако, А - это не частотный фактор, его следует называть предэкспоненциальным множителем, а Е - кажущейся энергией активации.
Иногда наблюдается компенсация А и Е, т.е. они изменяются в одном направлении при изменении катализатора в данной реакции или при изменении реакции на данном катализаторе. Особый случай компенсации, называемый q -правилом, имеет место, когда, по крайней мере приблизительно,

где Tq - изокинетическая температура, т.е. температура, при которой все k будут одинаковыми.
Подобные рассуждения могут быть распространены на обратимые процессы. Они также применимы и к однофазным, жидким системам. В достаточно распространенном для гетерогенных катализаторов случае, когда один реагент находится в газовой фазе, а другие реагенты и продукты - в жидкой фазе, вышеупомянутые принципы применяются непосредственно при условии, что существует равновесие массопереноса между газовой и жидкой фазами, т.е. фугитивность реагентов в газовой фазе равна их фугитивности в жидкой фазе. В таком случае степенной закон скорости для необратимой реакции в форме
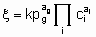
может применяться там, где величины имеют те же значения, что и раньше, за исключением того, что газообразный реагент g вводится не как ci, а как член давления с порядком ag.
Определение скорости реакции в проточной системе требует знания как скорости подачи, v, данного реагента, так и степени конверсии, x. Определение скорости подачи как количества реагента, подаваемого в единицу времени на вход в реактор, согласуется с §1.5.1. Тогда скорость реакции будет
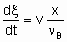
где n B - стехиометрический коэффициент реагента со степенью конверсии х. С другой стороны, можно исходить из rm, ri, и ra, а не dx /dt, определяя объемные скорости, vm, vv и va, где величины vi представляют собой скорость подачи данного реагента на единицу массы, объема или поверхности катализатора. Соотношение
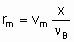
дает удельную скорость реакции или, при определенных условиях, удельную активность катализатора. Подстановка va или vv дает поверхностную скорость реакции или скорость, деленную на объем катализатора, соответственно. С другой стороны, можно использовать величины объемного времени t m, t a и t v, обратные объемным скоростям. "Время контакта" и "время пребывания" - термины, которые могут вводит в заблуждение при рассмотрении проточных систем в гетерогенном катализе, их лучше избегать.
1.5.4 Кинетические аспекты механизма
При рассмотрении механизмов удобно использовать такие понятия, как лимитирующий скорость процесс или стадия и преобладающий поверхностный интермедиат. Скорость-лимитирующий процесс определяется, как обычно в общем случае в кинетике, как такой элементарный процесс в каталитической последовательности, который не находится в равновесии, когда суммарная реакция удаляется от равновесия. Если поверхность катализатора содержит каталитические центры одного типа, данный интермедиат называют преобладающим поверхностным интермедиатом, если он покрывает намного большую часть поверхности, чем каждый из остальных интермедиатов. Конечно, нет гарантии, что скорость-лимитирующий процесс или преобладающий поверхностный интермедиат будут существовать для каждой отдельной реакции при определенном наборе условий.
Термин реакционный центр (reaction center) может относиться как к вакантным, так и к занятым каталитическим центрам (catalytic sites). Сумма поверхностных концентраций реакционных центров есть величина постоянная L. Таким образом, если группы m с поверхностной концентрацией Lm - преобладающий поверхностный интермедиат, Lm + Lv » L, где Lv - поверхностная концентрация вакантных реакционных центров.
Механизм Лэнгмюра-Хиншельвуда. Это несколько необычное применение термина "механизм" для определения относительных величин констант скоростей. В механизме Лэнгмюра-Хиншельвуда все стадии адсорбции-десорбции находятся, в основном, в равновесии, а скорость определяющей является поверхностная стадия. Такая поверхностная стадия может включать мономолекулярную реакцию одной молекулы адсорбата или реакцию двух или более молекул друг с другом на соседних местах. Там, где адсорбционные процессы идут по изотермам адсорбции Лэнгмюра, суммарная реакция будет подчиняться некоторой разновидности закона скорости Лэнгмюра (§1.5.3). Однако термин "механизм Лэнгмюра-Хиншельвуда" может относиться к ситуациям, в которых не применяются изотермы адсорбции Лэнгмюра.
1.5.5 Неоднородность каталитических центров
Для каталитической поверхности характерно то, что ее центры могут различаться по термодинамическим и кинетическим свойствам. В кинетическом описании каталитических реакций на неоднородных центрах параметр a часто используется, чтобы связать изменения энергии активации активированной адсорбции с энтальпией адсорбции
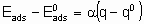
где 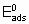 - энергия активации, а
- энергия активации, а
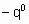 - энтальпия адсорбции на непокрытой поверхности. Eads и q относятся к поверхности с одинаковой величиной q . На практике это уравнение может применяться только в ограниченном диапазоне q . Иногда a
определяется так же, как в вышеупомянутом уравнении, но в терминах энергии активации Гиббса и адсорбции, соответственно. Термин коэффициент переноса использовался электрохимиками для выражения a в других условиях.
- энтальпия адсорбции на непокрытой поверхности. Eads и q относятся к поверхности с одинаковой величиной q . На практике это уравнение может применяться только в ограниченном диапазоне q . Иногда a
определяется так же, как в вышеупомянутом уравнении, но в терминах энергии активации Гиббса и адсорбции, соответственно. Термин коэффициент переноса использовался электрохимиками для выражения a в других условиях.
Перевод Е.Б. Никифоровой